Blog Archives
Viermal so viele Informationen pro Zelle
Wissenschaftler*innen des Berlin Institute of Health in der Charité (BIH) und des MDC haben gemeinsam mit Forscher*innen aus den USA und Japan die Analyse von Einzelzellen auf eine neue Stufe der Präzision gehoben: Sie kombinierten Methoden, mit denen man die mRNA, die strukturelle Zugänglichkeit der DNA, die hergestellten Proteine sowie Mutationen in der mitochondrialen DNA bestimmt, und waren so in der Lage, alle diese Informationen von tausenden einzelner Zellen gleichzeitig zu erfassen. Ihre Ergebnisse haben sie nun in der Zeitschrift Nature Biotechnology veröffentlicht.
Bislang verstanden Biolog*innen unter der Single-Cell-Analyse insbesondere die Bestimmung des messenger RNA (mRNA)-Profils einzelner Zellen. Diese Botenstoffe überbringen die Information aus dem Erbgut im Zellkern, der DNA, in das Zellplasma, wo die mRNA in Eiweiß (Protein) übersetzt wird. In jeder Zelle ist der Gehalt und die Zusammensetzung der mRNA individuell verschieden. So werden in Nervenzellen andere Proteine benötigt als in Leberzellen und entsprechend andere Gene auf der DNA abgelesen und in mRNA umgeschrieben.
„Das Bild von der Zelle allein auf Basis des mRNA-Profils ist jedoch unvollständig“, erklärt Leif S. Ludwig, Leiter der Emmy-Noether-Nachwuchsgruppe „Stammzelldynamiken und mitochondriale Genomik“ am BIH und MDC, und einer der leitenden Autoren der nun veröffentlichten Arbeit. Die Gruppe gehört seit kurzem dem gemeinsamen Forschungsfokus „Single-Cell-Ansätze für die personalisierte Medizin“ an, den das BIH in der Charité gemeinsam mit dem MDC und der Charité gegründet hat. „Es werden nicht immer alle mRNA-Moleküle 1:1 in Protein übersetzt und nicht für jedes Gen ist die Menge an mRNA gut messbar. Wenn wir nun gleichzeitig die Proteinmenge bestimmen können, gibt uns das ein umfassenderes Bild von den Vorgängen in der Zelle.“
Verstehen, warum die Zelle manche Gene häufiger abliest
Gemeinsam mit einem internationalen Team von Kolleg*innen aus den USA und Japan bestimmten die Wissenschaftler*innen neben der mRNA und Protein-Profilen auch die „Zugänglichkeit“ der DNA in einzelnen Zellen. Denn das Erbgut der Zelle liegt nicht ungeschützt im Kern, sondern bildet einen dichten Komplex namens Chromatin: Stellen, an denen das Chromatin lockerer vorliegt, können leichter in mRNA abgeschrieben werden, besonders dichte Stellen werden kaum benutzt. „Daraus können wir erkennen, ob die DNA-Struktur mit der mRNA-Menge zusammenhängt, und können so besser verstehen, warum manche Gene häufiger als andere abgelesen werden“, sagt der promovierte Biochemiker und Humanmediziner.
Mit seiner Gruppe, die am Berliner Institut für medizinische Systembiologie ( BIMSB ) des MDC angesiedelt ist, erforscht Leif S. Ludwig zudem das Erbgut von Mitochondrien – den „Kraftwerken“ der Zelle – welche über eine eigene DNA verfügen. So untersuchen sie beispielsweise, wie sich Veränderungen in der mitochondrialen DNA auf Erkrankungen beim Menschen auswirken. „Es lag daher für uns nahe, auch die mitochondriale DNA in die Single Cell Analyse mit einzubeziehen“, erklärt Leif S. Ludwig. Damit sind die Wissenschaftler*innen die ersten weltweit, die bei der Einzelzellanalyse vier Parameter gleichzeitig untersuchen können. Und das ist wichtig, auch für die Medizin. „Je genauer es uns gelingt, zum Beispiel Krebszellen unter die Lupe zu nehmen, desto besser verstehen wir, was in der Zelle falsch läuft. Und können damit auch die Behandlung präzise anpassen.“
Die klinische Anwendung seiner Ergebnisse verfolgt er unter anderem gemeinsam mit seinen klinischen Partnern an der Charité, den Direktoren der Medizinischen Kliniken mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie, Professor Lars Bullinger am Charité Campus Virchow-Klinikum (CVK) sowie Professor Ulrich Keller am Charité Campus Benjamin Franklin (CBF).
Vier neue Gruppen nutzen Einzelzellmethoden
Vier neue Gruppen nutzen Einzelzellmethoden für die Medizin
Modernste Technologien für den klinischen Einsatz
Den Kern des neuen Forschungsfokus bilden vier neue Nachwuchsforschungsgruppen, deren Leiter*innen international berufen wurden: Dr. Leif Ludwig, der vom Broad Institute in Cambridge, USA nach Berlin gekommen ist, will mit seiner Gruppe die Entwicklung und Aktivität von Stammzellen im Zusammenhang mit dem Erbgut ihrer „Zellkraftwerke“, den Mitochondrien, untersuchen. Dr. Simon Haas kommt vom Deutschen Krebsforschungszentrum in Heidelberg und analysiert Krebsstammzellen, um damit den Ursprung von Blutkrebserkrankungen gezielt angehen zu können. Dr. Stefanie Grosswendt vom Berliner Max-Planck-Institut für molekulare Genetik möchte herausfinden, welche Zelltypen und Vorgänge aus der Embryonalentwicklung im Krankheitsbild bestimmter Krebsarten eine Rolle spielen. Die Kanadierin Dr. Ashley Sanders war bisher am Europäischen Molekularbiologischen Labor in Heidelberg und erforscht, wie neue Mutationen in einzelnen Zellen entstehen und so deren unterschiedliche Ausprägung innerhalb eines Organs oder Tumors bedingen.
Die Nachwuchsgruppen werden am MDC in Mitte, und somit am Berliner Institut für Molekulare Systembiologie (BIMSB), angesiedelt sein. Hier haben sie Zugang zu neuesten Einzelzellmethoden und kooperieren mit exzellenten Systembiologen. BIMSB-Direktor Professor Nikolaus Rajewsky hat selbst entscheidende Beiträge zur Einzelzelltechnologie geleistet. „Das ist so, als ob wir ein Supermikroskop erfunden hätten, mit dem wir plötzlich in jede Zelle in einem Gewebe hineinschauen könnten, in alle Zellen gleichzeitig, und sehen könnten, was molekular in der Zelle vor sich geht – zum Beispiel wann und warum sie krank wird.“ Nikolaus Rajewsky und Professorin Angelika Eggert, Direktorin der Klinik für Pädiatrie mit Schwerpunkt Onkologie und Hämatologie an der Charité, sind Sprecher und Sprecherin des neuen BIH-Forschungsfokus.

Aus Gewebe isolierte Zellen, werden in Miniaturchips zur Verarbeitung einzelner Zellen kanalisiert. © Felix Petermann, MDC
Zusammenarbeit mit Kliniker*innen
Das BIMSB befindet sich in Berlin Mitte und damit in unmittelbarer Nähe zum Campus Charité Mitte (CCM). Das erweist sich als großer Vorteil für ihre translationale Arbeit, denn die Nachwuchsgruppen werden jeweils eng mit einer Klinik der Charité zusammenarbeiten, um die Einzelzelltechnologien für konkrete medizinische Fragestellungen und deren klinischen Einsatz zu etablieren: Ashley Sanders wird mit Britta Siegmund, der Direktorin der Medizinischen Klinik für Gastroenterologie, Infektiologie und Rheumatologie, kooperieren. Angelika Eggert ist klinische Partnerin von Stefanie Grosswendt. Simon Haas und Leif Ludwig werden mit den Direktoren der beiden Medizinischen Kliniken mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie zusammenarbeiten, Lars Bullinger am Campus Virchow-Klinikum (CVK) sowie Ulrich Keller am Campus Benjamin Franklin (CBF).
„Ich glaube, dass insbesondere die Krebsforschung von den neuen Single-Cell-Technologien profitieren wird“, sagt Angelika Eggert. „Denn Tumoren bestehen keineswegs aus lauter gleichartigen Zellen, sondern sind oft ein sehr heterogenes Gemisch aus unterschiedlich differenzierten Krebszellen, Bindegewebs-, Blutgefäß- und Immunzellen. Je genauer man die zelluläre Zusammensetzung eines Tumors kennt, desto gezielter kann man ihn bekämpfen.“
Der Beginn eines „Cell Hospitals“
„Ich freue mich sehr und bin auch ein bisschen stolz, dass wir diese tollen jungen Leute nach Berlin holen konnten“, sagt Nikolaus Rajewsky. Gleichzeitig ist auch das Angebot für die jungen Forscher*innen besonders attraktiv. Während man als Forscherin oder Forscher den molekularen Details auf den Grund gehen kann, fragen die assoziierten Ärzt*innen nach der klinischen Relevanz der Ergebnisse und ermöglichen den Forschenden Einblicke in Krankheitsfälle, die mithilfe von Einzelzelltechnologien aufgeklärt werden können.
„In diesem Sinne betrachte ich diese Initiative als den Beginn eines ‘Cell Hospitals‘, in dem die Grundlagenforschung des MDC/BIMSB, die klinische Forschung an der Charité und die translationale Forschung des BIH zusammenkommen“, sagt Nikolaus Rajewsky. „Nicht nur, um die Mechanismen zu verstehen, warum Zellen krank werden, sondern auch, um diese Zellen so frühzeitig zu entdecken, dass man sie wieder auf den Pfad des Gesunden zurückbringen kann. Ich bin mir sicher, dass wir zumindest für einige Krankheiten signifikante Fortschritte machen werden.“
Quelle: PM des MDC vom 02. 02. 2021
Was tanzende Spaghetti im Gehirn anrichten
In lebenden Organismen herrscht das Chaos. Die Biophysik versucht, diese Unordnung zu durchdringen und zu verstehen, wie sie sich organisiert. Auf diesem noch relativ jungen Forschungsfeld ist Melissa Birol unterwegs. Die Griechin baut als neue Juniorgruppenleiterin seit dem 1. Dezember am Berliner Institut für Medizinische Systembiologie (BIMSB) die Arbeitsgruppe „Molekulare Biophysik in der quantitativen Neurowissenschaft“ auf. Das BIMSB gehört zum Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC).
Nach ihrem Masterstudium und der anschließenden Promotion in theoretischer Biophysik wollte Melissa Birol dies auf die zelluläre Ebene übertragen, indem sie Erfahrungen mit praktischer und experimenteller Arbeit sammelte. So fand sie zur molekularen Biophysik. Die Faszination für ungeordnete Systeme haben ihr Biophysikerin Elizabeth Rhoades und Biophysiker Andrew Miranker vermittelt. Mit beiden Wissenschaftlern hat sie als Postdoktorandin zusammengearbeitet, erst in Yale, seit 2016 dann an der University of Pennsylvania.
Funktion der ungeordneten Proteine bislang ungeklärt
Am BIMSB wird sie das Verhalten der intrinsisch ungeordneten Proteine (intrinsically disordered proteins, IDPs) erforschen. Diese IDPs sind an neurodegenerativen Erkrankungen wie Alzheimer, Parkinson oder amyotropher Lateralsklerose (ALS), einer unheilbaren Nervenerkrankung, die zu spastischen Lähmungen führt, beteiligt. „Diese Proteine sind gut erforscht. Es ist zum Beispiel genau bekannt, welche IDPs mit welchen Erkrankungen in Zusammenhang stehen“, sagt Birol. „Trotzdem weiß man weder, welche Funktion sie eigentlich haben, noch weiß man, was genau in den Zellen passiert, wenn sie ihre Funktion einbüßen und schließlich diese Erkrankungen auslösen.“
Mit Lasermikroskop oder Spektroskop wird Birol Hirn-Organoide untersuchen, aus menschlichen Stammzellen geschaffene Mini-Organe, die das Gehirn in der Petrischale nachbilden. Mit dieser Kombination aus optischen Werkzeugen und biologischen Systemen will sie nachvollziehen, wie die Proteine in die Hirnzellen eindringen, sich dort verhalten und wie neurodegenerative Erkrankungen voranschreiten. Dabei will sie nicht nur beobachten, sondern vor allem physikalisch messen, was passiert.
Bei der Diagnose ist es zu spät für eine Therapie
Ungeordnete Proteine haben keine feste Struktur. „Sie sind wie Spaghetti, die in der Zelle tanzen“, beschreibt die Neurowissenschaftlerin das, was sie unter dem Mikroskop sieht. Sie beobachtet, welche Zustände die IDPs durchlaufen. Am Anfang ist dort nur ein einzelnes diffuses Molekül zu sehen. Dieses verbindet sich mit anderen zu einem formlosen, dynamischen Gebilde, das tatsächlich an gekringelte Spaghetti erinnert, und findet sich mit anderen Zellbestandteilen zusammen. Schließlich gehen sie in einen unbeweglichen, faserartigen Zustand über. So bilden sie die Eiweißablagerungen im Gehirn, die typisch sind für Parkinson oder eine Alzheimer-Erkrankung.
„Wenn wir diese Plaques sehen, ist es zu spät. Die Krankheit lässt sich dann nicht mehr aufhalten“, sagt Birol. Deshalb möchte sie herausfinden, was und warum im Frühstadium mit den IDPs passiert. „Wenn wir wissen, warum sie erst miteinander tanzen und dann miteinander erstarren, können wir therapeutische Ansätze entwickeln, die diesen Prozess stoppen.“
Birol beschränkt sich dabei nicht auf die Vorgänge in den Neuronen, sondern nimmt auch die Mikrogliazellen ins Visier. Mikrogliazellen sind so etwas wie die die Wächter über die grauen Zellen. Sie sind mit feinen Härchen ausgestattet, mit denen sie ständig über das Hirngewebe hinwegtasten und beispielsweise Keime abwehren. Dabei reagieren sie auch auf Proteinablagerungen. Die verklumpten IDPs bleiben nämlich nicht in einem Neuron stecken. Sie diffundieren durch die Zellmembran und verbreiten sich von einem Neuron zum nächsten und schließlich im gesamten Gehirn. Es könnte ein Ansatzpunkt im Kampf gegen neurodegenerative Krankheiten sein, sagt Birol, die Mikrogliazellen dazu zu bringen, die IDPs wegzuräumen. Darüber hinaus will die Wissenschaftlerin auch untersuchen, wie die IDPs mit Zellmembranen interagieren. Möglicherweise können letztere die Ausbreitung im Gehirn verhindern.
Birol freut sich auf die interdisziplinäre Zusammenarbeit am MDC: Insbesondere möchte sie experimentelle mit rechnergestützten Ansätzen kombinieren, sowohl in ihrer eigenen Arbeitsgruppe als auch mit anderen Wissenschaftler*innen.
Text: Jana Ehrhardt-Joswig
Quelle: PM des MDC vom 12. 01. 2021
Neuer PI stärkt Austausch zwischen MDC und Charité
Das MDC begrüßt einen neuen Gast: Dr. Michael Sigal, klinischer Wissenschaftler und Arzt an der Charité – Universitätsmedizin Berlin, untersucht, welchen Einfluss Stammzellen auf Magen-Darm-Erkrankungen und Krebs haben. Am MDC möchte er die Darmwand auf Einzelzellebene erforschen.
Schon als Medizinstudent war Dr. Michael Sigal begeistert von den Mechanismen des menschlichen Körpers, die ihn so präzise regulieren wie eine perfekt eingestellte Maschine.
„Ich wollte nicht nur Arzt sein, der Patientinnen und Patienten behandelt“, erinnert sich Sigal, der heute als Oberarzt an der Charité mit Schwerpunkt Gastroenterologie arbeitet. „Schon immer wollte ich verstehen, wie die Dinge funktionieren und welche Mechanismen sie beeinträchtigen.“
Sigal startet die Nachwuchsgruppe „Gastrointestinale Barriere, Regeneration und Karzinogenese“ am Berliner Institut für Medizinische Systembiologie (BIMSB), das zum Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) gehört. Die Stelle an der Charité behält er bei, in den Laboren des MDC wird Sigal als Gast-Wissenschaftler eng mit den MDC-Teams zusammenarbeiten.
Meister der Regeneration: das Epithel
Sigal untersucht das Epithel des Gastrointestinaltrakts (GI): Zellen, die Magen und Darm auskleiden und eine wichtige Barriere zwischen unserem Körper und der Außenwelt bilden. „Das Darmepithel hat eine unglaubliche Regenerationsfähigkeit“, sagt Sigal. „Jede Woche werden etwa 300 Gramm Epithelzellen ausgeschieden und von den Stammzellen ersetzt. Das ist die höchste Umsatzrate aller Gewebe im menschlichen Körper.“
Ihn interessiert besonders, wie dieser Regenerationsprozess funktioniert. Wie kann das Zusammenspiel zwischen normalem Mikrobiom und infektiösen Bakterien zur Regeneration beitragen, diesen Prozess stören und letztlich entzündliche Darmerkrankungen und Krebs auslösen? „Jede gastrointestinale Erkrankung des Magens und des Darms ist auch eine Erkrankung des Epithels“, sagt Sigal.
Einige überraschende Ergebnisse hat er bereits gefunden.
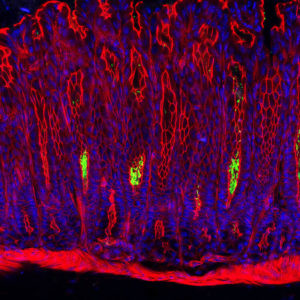
Querschnitt durch die Magenschleimhaut (Mausmodell): Helicobacter-pylori-Bakterien (grün) besiedeln die Vertiefungen der Magendrüsen. Die Kerne der Schleimhautzellen sind blau, ihr Zellskelett rot angefärbt.
© Michael Sigal, Charité
Während eines zweijährigen Forschungsaufenthaltes an der Stanford University erforschte er das Bakterium Helicobacter pylori, das etwa 50 Prozent aller Menschen weltweit im Magen tragen. Er und seine Kolleg*innen entdeckten, dass diese Bakterien direkt mit den epithelialen Stammzellen des Magens interagieren. Das kann zur Fehlregulation dieser Zellen und schließlich zur Entwicklung von Magenerkrankungen führen.
Arzt und Wissenschaftler
Als „Clinician Scientist“, bis vor kurzem im Rahmen eines dreijährigen Programms des BIH und Charité gefördert, teilt Sigal seine Arbeitszeit zwischen Klinik und Grundlagenforschung auf. Er betrachtet diese doppelte Perspektive als klaren Vorteil für beide Bereiche. Als Arzt sieht er umgehend, welche Herausforderungen es zu bewältigen gilt. „In der Klinik gibt es so vieles, was wir nicht genau verstehen“, sagt er. „Warum treten Krankheiten auf? Warum sprechen manche Patientinnen und Patienten auf Medikamente an, andere dagegen nicht?“ Als qualifizierter Wissenschaftler bringt er diese Fragen ins Labor. Die Erkenntnisse aus der Grundlagenforschung können im Idealfall zu einer neuen wirksameren Behandlung der Patient*innen führen.
Eine wichtige Verbindung
Im Jahr 2019 erhielt Sigal im Emmy Noether-Programm der Deutschen Forschungsgemeinschaft (DFG ) Fördermittel für die eigenverantwortliche Leitung einer Nachwuchsgruppe. Der offizielle Arbeitsplatz der Gruppe ist die Charité, doch er und sein sechsköpfiges Team nutzen ab jetzt auch Laborräume im BIMSB des MDC – direkt gegenüber der Charité in Berlin-Mitte.
Nun will er seine Arbeit auf einer neuen Ebene fortführen. Am BIMSB will er erforschen, wie Zellen miteinander kommunizieren. Er profitiert dabei von der Ausstattung und dem Know-how zu Einzelzellanalysen und zellulärer Kommunikation, die in räumlicher Auflösung untersucht werden kann, sowie von einzigartiger Expertise in der Bioinformatik. „So gewinnen wir viel tiefere Einblicke in die Funktionsweise des Epithels“, sagt Sigal. „Das BIMSB ist der ideale Ort hierfür, denn viele Gruppen dort befassen sich mit der Zellregulation. Sie setzen Werkzeuge ein, die eine Auflösung der Vorgänge auf Einzelzellebene erlauben, die bisher so nicht möglich war und nur an wenigen Orten weltweit auf einem so hohen Niveau praktiziert wird.”
Sigal hofft, dass die Erforschung des Magen-Darm-Epithels und seine klinische Perspektive auch für andere Teams am MDC von Interesse und Nutzen sein werden. So ist der Gastrointestinaltrakt beispielsweise gut dafür geeignet, die Entstehung von Krankheiten zu untersuchen, lange bevor sie sich zu einem späteren Zeitpunkt zu Krebs entwickeln. „Ich denke, wir können viel voneinander lernen“, sagt er und fügt hinzu: „Wahre Innovationen entstehen durch interdisziplinäre Arbeit“.
Ort der Begegnung
Sigal ist ein großer Befürworter einer verstärkten Zusammenarbeit zwischen den beiden Institutionen. Er ist überzeugt, dass der bloße Aufenthalt im selben Gebäude zu überraschenden Diskussionen und neuen Ideen führen wird. Die Kooperation zwischen dem MDC und der Charité, findet er, soll nur ein Beispiel von vielen sein, wie die Stadt die Kultur eines offenen wissenschaftlichen Austausches fördert.
Text: Laura Petersen
Quelle: PM MDC vom 24. 08. 2020
MDC Berlin, Campus Berlin-Buch












